Giải SBT Hóa 10 Bài 30: Lưu huỳnh (ngắn gọn)
Mời các em học sinh và quý thầy cô tham khảo ngay hướng dẫn giải Giải SBT Hóa học 10 Bài 30: Lưu huỳnh (chính xác nhất) được đội ngũ chuyên gia biên soạn ngắn gọn và đầy đủ dưới đây.
Mục Lục
Giải Hóa học 10 Bài 30 SBT: Lưu huỳnh
Bài 30.1 trang 66 sách bài tập Hóa 10
Câu nào sau đây miêu tả đúng đặc thù hoá học của lưu huỳnh ? A. Lưu huỳnh chỉ có tính oxi hoá.
B. Lưu huỳnh chỉ có tính khử.
Bạn đang đọc: Giải SBT Hóa 10 Bài 30: Lưu huỳnh (ngắn gọn)
C. Lưu huỳnh vừa có tính oxi hoá, vừa có tính khử. D. Lưu huỳnh không cố tính oxi hoá và không có tính khử.
Lời giải:
Đáp án C
Bài 30.2 trang 66 sách bài tập Hóa 10
Liên kết hoá học giữa nguyên tử của nguyên tố nào với nguyên tử natri trong hợp chất sau thuộc loại link cộng hoá trị có cực ? A. Na2S B. Na2O C. NaCl D. NaF
Lời giải:
Đáp án A
Bài 30.3 trang 66 sách bài tập Hóa 10
Cho PTHH : 4F eS2 + 11O2 → 2F e2O3 + 8SO2 Cần đốt cháy bao nhiêu mol FeS2 để thu được 64 gam SO2 theo PTHH trên ? A. 0,4 mol. B. 0,5 mol. C. 0,8 mol. D. 1,2 mol.
Lời giải:
Đáp án B
Bài 30.4 trang 66 sách bài tập Hóa 10
Câu nào sau đây đúng A. Lưu huỳnh ở ô 32 trong bảng HTTH B. Lưu huỳnh ở thể khí trong điều kiện kèm theo thường C. Lưu huỳnh vừa có tính oxi hóa, vừa có tính khử D. Lưu huỳnh luôn có số oxi hóa – 2 trong mọi hợp chất
Lời giải:
Đáp án C
Bài 30.5 trang 66 sách bài tập Hóa 10
Lưu huỳnh có những số oxi hóa nào sau đây A. – 2 ; – 4 ; + 6 ; + 8 B. – 1 ; 0 ; + 2 ; + 4 C. – 2 ; + 6 ; + 4 : 0 D. – 2 ; – 4 ; – 6 ; 0
Lời giải:
Đáp án C
Bài 30.6 trang 67 sách bài tập Hóa 10
Đốt nóng một hỗn hợp gồm 5,6 gam bột sắt và 1,6 gam bột lưu huỳnh trong thiên nhiên và môi trường không có không khí, thu được hỗn hợp rắn X. Cho hỗn hợp X phản ứng trọn vẹn với 500 ml dung dịch HCL, thu được hỗn hợp khí A và dung dịch B ( hiệu suất của những phản ứng là 100 % ). a ) Tính thành phần Xác Suất theo thể tích của hỗn hợp khí A b ) Biết rằng cần dùng 125 ml dung dịch NaOH 0,1 M để trung hoà HCL còn dư trong dung dịch B, hãy tính nồng độ mol của dung dịch HCl đã dùng.
Lời giải:
Các PTHH : Fe + S → FeS ( 1 ) FeS + 2HC l → FeCl2 + H2S ( 2 ) Fe ( dư ) + 2HC l → FeCl2 + H2 ( 3 ) HCl ( dư ) + NaOH → NaCl + H2O ( 4 ) a ) Thành phần của hỗn hợp khí A : Theo ( 1 ) : 0,05 mol Fe tính năng với 0,05 mol S, sinh ra 0,05 mol FeS. Theo ( 2 ) : 0,05 mol FeS tính năng với 0,10 mol HCl, sinh ra 0,05 mol H2S Theo ( 3 ) : 0,05 moi Fe dư công dụng với 0,10 mol HCl, sinh ra 0,05 mol HCl Kết luận : Hỗn hợp khí A có thành phần Xác Suất theo thể tích : 50 % khí H2S và 50 % khí H2 b ) Nồng độ mol của dung dịch HCL : Tổng số mol HCL tham gia những phản ứng ( 2 ), ( 3 ), ( 4 ) : 0,1 + 0,1 + 0,0125 = 0,2125 ( mol ) Nồng độ mol của dung dịch HCl : 0,2125 / 0,5 = 0,425 ( mol / l )
Bài 30.7 trang 67 sách bài tập Hóa 10
Viết phương trình hoá học của những phản ứng hoàn thành xong chuỗi phản ứng sau :
Lời giải:
( 1 ) S + H2 to → H2S ( 2 ) 2H2 S + 3O2 to → 2SO2 + 2H2 O ( 3 ) SO2 + Br2 + 2H2 Oto → H2SO4 + 2HB r ( 4 ) Cu + H2SO4 đặc nóng → CuSO4 + SO2 + 2H2 O ( 5 ) SO2 + 2M g → S + 2M gO ( 6 ) S + O2 to → SO2 ( 7 ) SO2 + 6HI → H2S + 3I2 + 2H2 O ( 8 ) H2S + Cl2 → S + 2HC l ( 9 ) S + 6HNO3 đặc nóng → H2SO4 + 6NO2 + 2H2 O
Bài 30.8 trang 67 sách bài tập Hóa 10
Cho sơ đồ chuỗi phản ứng : Biết rằng : X1 là hợp chất của 1 sắt kẽm kim loại và 1 phi kim. A1, A2, A3, Z1 là những hợp chất của lưu huỳnh B1, B3, B5, Z1 là hợp chất của đồng hoặc đồng sắt kẽm kim loại. Hãy viết PTHH của chuỗi phản ứng ( có ghi điều kiện kèm theo ) xảy ra theo sơ đồ trên.
Lời giải:
CuS + 3/2 O2 to → CuO + SO2 ( 1 ) SO2 + Br2 + 2H2 O → 2HB r + H2SO4 ( 2 ) H2SO4 + Ag2O → Ag2SO4 + H2O ( 3 ) CuO + H2 to → Cu + H2O ( 4 ) Cu + Cl2 to → CuCl2 ( 5 ) Cu + 2H2 SO4 → CuSO4 + SO2 + 2H2 O ( 6 ) Ag2SO4 + CuCl2 → 2A gCl + CuSO4 ( 7 ) CuSO4 + H2S → CuS + H2SO4 ( 8 )
Bài 30.9 trang 67 sách bài tập Hóa 10
Cho 1,10 gam hỗn hợp bột sắt và bột nhôm công dụng vừa đủ với 1,28 gam bột lưu huỳnh. a ) Viết PTHH của những phản ứng đã xảy ra. b ) Tính tỉ lệ % của sắt và nhôm trong hỗn hợp bắt đầu theo : + Lượng chất ( số mol ). + Khối lượng chất ( số gam ).
Lời giải:
Fe + S → FeS ( 1 ) x x ( mol ) 2A l + 3S to → Al2S3 y 3 y / 2 ( mol ) Đặt số mol Fe, Al lần lượt là x, y ta có hệ phương trình : 56 x + 27 y = 1,1 ( x + 3 y / 2 ). 32 = 1,28 Giải ra x = 0,01 và y = 0,02 b ) % nFe = 0,01 / 0,03 x 100 % = 33,33 % ; % nAl = 100 – 33,33 % = 66,667 % % mFe = 56.0,01 / 1,1 x 100 % = 50,90 % ; % mAl = 100 – 50,90 = 49,1 ( % )
Bài 30.10 trang 68 sách bài tập Hóa 10
Đun nóng một hỗn hợp gồm có 0,650 gam bột kẽm và 0,224 gam bột lưu huỳnh trong ống nghiệm đậy kín không có không khí. Sau phản ứng người ta thu được chất nào trong ống nghiệm ? Khối lượng là bao nhiêu ?
Lời giải:
nZn = 0,65 / 65 = 0,01 mol ; nS = 0,224 / 32 = 0,007 mol Zn + S → ZnS ( 1 ) Theo ( 1 ) sau phản ứng trong ống nghiệm thu được : nZnS = 0,007 mol mZnS = 0,007 x97 = 0,679 ( g ) nZn dư = ( 0,01 – 0,007 ) = 0,003 mol mZn dư = 65.0,003 = 0,195 g
Bài 30.11 trang 68 sách bài tập Hóa 10
Đốt cháy lưu huỳnh trong bình đựng không khí, lưu huỳnh cháy hết. Tính tỉ khối so với He của hỗn hợp khí thu được sau phản ứng, nếu oxi trong bình vừa đủ đốt cháy hết S.
Lời giải:
Nitơ chiếm 80 % thể tích không khí, điều đó có nghĩa là trong không khí mỗi khi có 1 mol oxi sẽ có 4 mol nitơ. S + O2 → SO2
Khi tạo thành 1 mol SO2 hì hỗn hợp thu được gồm 1 mol SO2 và 4 mol N2
Tỉ khối của hỗn hợp so với He là : d = 35,2 / 4 = 8,8
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải SBT Hóa 10 Bài 30: Lưu huỳnh (ngắn gọn nhất) file PDF hoàn toàn miễn phí.
Source: https://evbn.org
Category : blog Leading

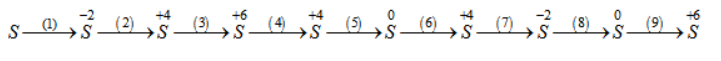
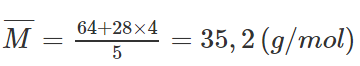













![Toni Kroos là ai? [ sự thật về tiểu sử đầy đủ Toni Kroos ]](https://evbn.org/wp-content/uploads/New-Project-6635-1671934592.jpg)


